Škrob. Nalaz u prirodi, praktični značaj, hidroliza škroba.
Škrob nastaje u biljkama tijekom fotosinteze i taloži se u korijenu i sjemenu. On je bijeli prah, netopiv u hladna voda i stvaranje koloidne otopine u Vruća voda.
Škrob je prirodni polimer formiran od ostataka α-glukoze i izgleda ovako:
Kompleks škroba i joda ima karakterističnu plavu boju. Ova reakcija služi za otkrivanje škroba.
Kemijska svojstva. Kada se zagrijava u kiselom mediju, škrob se hidrolizira, razbijajući veze između ostataka α-glukoze. Time se proizvodi niz međuproizvoda, posebice maltoza. Krajnji proizvod hidrolize je glukoza:
Ova reakcija je od velike industrijske važnosti jer se iz glukoze dobivaju etanol, mliječna kiselina i drugi vrijedni proizvodi.
Škrob je vrijedan hranjiv proizvod. Dio je kruha, krumpira, žitarica i, uz saharozu, najvažniji je izvor ugljikohidrata u ljudskom tijelu.
Željezo: položaj u periodnom sustavu kemijski elementi D. I. Mendeljejev, struktura atoma, moguća oksidacijska stanja, fizikalna svojstva, interakcija s kisikom, halogenima, otopinama kiselina i soli. Legure željeza.
Željezo je u sporednoj podskupini skupine VIII periodnog sustava. Elektronska formula atoma željeza:
![]()
Tipična oksidacijska stanja željeza su +2 i +3. Oksidacijsko stanje +2 očituje se gubitkom dvaju 4s elektrona. Oksidacijsko stanje +3 također odgovara gubitku još jednog 3d elektrona, dok je 3d razina napola popunjena; takve su elektroničke konfiguracije relativno stabilne.
Fizička svojstva. Željezo je tipičan metal, stvara metalik kristalna rešetka. Željezo provodi električnu struju, prilično je vatrostalno, talište je 1539°S. Željezo se od većine drugih metala razlikuje po svojoj sposobnosti magnetiziranja.
Kemijska svojstva.
Željezo reagira s mnogim nemetalima:
![]()
Nastaje željezni kamenac – miješani željezni oksid. Njegova formula je također napisana ovako: FeO Fe 2 O 3.
![]()
Reagira s kiselinama i oslobađa vodik:
Ulazi u supstitucijske reakcije s lociranim metalnim solima desno od željeza u nizu napona:
spojevi željeza. FeO - bazični oksid, reagira s kiselim otopinama i stvara soli željeza (II). Fe 2 O 3 je amfoterni oksid koji također reagira s otopinama lužina.

Željezni hidroksidi. Fe (OH) 2 je tipičan bazični oksid, Fe (OH) 3 ima amfoterna svojstva, ne reagira samo s kiselinama, već i s koncentriranim otopinama lužina.

Željezov (II) hidroksid se lako oksidira u željezov (III) hidroksid pomoću atmosferskog kisika:
Kada soli željeza (II) i (III) reagiraju s lužinama, talože se netopivi hidroksidi:
legure željeza. Suvremena metalurška industrija proizvodi legure željeza različitih sastava.
Sve legure željeza podijeljene su po sastavu i svojstvima u dvije skupine. Prva skupina uključuje različite vrste lijevanog željeza, druga - različite vrste čelika.
Lijevano željezo je krhko; čelici su plastični, mogu se kovati, valjati, vući, štancati. Razlika u mehaničkim svojstvima lijevanog željeza i čelika ovisi prvenstveno o njihovom sadržaju ugljika – lijevano željezo sadrži oko 4% ugljika, a čelici obično manje od 1,4%.
U suvremenoj metalurgiji željezne rude se prvo koriste za proizvodnju lijevanog željeza, a zatim od lijevanog željeza u čelik. Lijevano željezo se topi u visokim pećima, čelik se topi u čeličnim pećima. Do 90% svega topljenog sirovog željeza prerađuje se u čelik.
Lijevano željezo. Sirovo željezo namijenjeno preradi u čelik naziva se sirovo željezo. Sadrži od 3,9 do 4,3% C, 0,3-1,5% Si, 1,5-3,5% Mn, ne više od 0,3% P i ne više od 0,07% S. Lijevano željezo, namijenjeno "proizvodnji odljevaka, naziva se ljevačko željezo U visokim pećima se tope i ferolegure koje se uglavnom koriste u proizvodnji čelika kao aditivi.Ferolegure u odnosu na sirovo željezo imaju visok sadržaj silicija (ferosilicij), mangana (feromangana), kroma (ferohrom) i dr. elementi.
Postati. Svi čelici se dijele na ugljične i legirane čelike.
Ugljični čelici sadrže nekoliko puta manje ugljika, silicija i mangana od lijevanog željeza, a vrlo malo fosfora i sumpora. Svojstva ugljičnog čelika prvenstveno ovise o sadržaju ugljika u njemu: što je više ugljika u čeliku, to je tvrđi. Industrija proizvodi blage čelike, čelike srednje tvrdoće i tvrde čelike. Za izradu dijelova strojeva, cijevi, vijaka, čavala i sl. koriste se blagi čelici i čelici srednje tvrdoće, a za izradu alata koriste se tvrdi čelici.
Čelici trebaju sadržavati što manje sumpora i fosfora, jer te nečistoće narušavaju mehanička svojstva čelika. U povećanim količinama, sumpor uzrokuje crvenu lomljivost - stvaranje pukotina tijekom vruće obrade metala. Fosfor uzrokuje hladnu lomljivost – lomljivost čelika na običnoj temperaturi. -
Legirani čelici. Fizikalna, kemijska i mehanička svojstva čelika značajno se mijenjaju od uvođenja u njihov sastav povećan iznos mangan i silicij, kao i krom, nikal, volfram i drugi elementi. Ti se elementi nazivaju legirajući, a čelik - legirani [od latinske riječi ligare - spajati, spajati].
Krom je najčešće korišteni legirajući element. Posebno veliku važnost za konstrukciju strojeva, aparata i mnogih dijelova strojeva imaju krom-nikl čelik. Ovi čelici imaju visoka plastičnost, čvrstoća, otpornost na toplinu i otpornost na oksidirajuća sredstva. Dušična kiselina bilo koje koncentracije ne uništava ih čak ni pri temperaturama ključanja. Krom-nikl čelici ne hrđaju u atmosferskim uvjetima i u vodi. sjajan, srebrna boja, listovi krom-nikl čelika krase lukove stanice Mayakovskaya moskovskog metroa. Nehrđajući noževi, žlice, vilice i ostali kućanski predmeti izrađeni su od istog čelika.
Molibden i vanadij povećavaju tvrdoću i čvrstoću čelika na povišene temperature i pritisci. Dakle, krom-molibden i krom-vanadij čelici koriste se za proizvodnju cjevovoda i dijelova kompresora u proizvodnji sintetičkog amonijaka, zrakoplovnih motora.
Prilikom rezanja velikom brzinom, alat se zagrijava i brzo se troši. Kada se doda volfram, tvrdoća čelika se održava čak i na povišenim temperaturama. Stoga se krom-volfram čelici koriste za proizvodnju reznih alata koji rade pri velikim brzinama.
Povećanje sadržaja mangana u čeliku povećava njegovu otpornost na trenje i udar. Manganski čelici koriste se za izradu željezničkih rampi, skretnica, križeva, drobilica kamena.
Korištenje legiranih čelika može značajno smanjiti težinu metalnih konstrukcija, povećati njihovu čvrstoću, izdržljivost i pouzdanost u radu.
Škrob i celuloza su predstavnici prirodni polimeri. Pronalaženje u prirodi. Svojstva, primjena.
Sat korištenja tehnologije za razvoj kritičkog mišljenja 11. razred
Sustavno-djelotvorni pristup omogućuje izdvajanje glavnih rezultata obrazovanja i odgoja u kontekstu ključnih zadataka i univerzalnih aktivnosti učenja kojima bi učenici trebali ovladati.
Ovladavanje univerzalnim aktivnostima učenja od strane učenika stvara mogućnost samostalnog uspješnog usvajanja novih znanja, vještina i kompetencija, uključujući organizaciju usvajanja, odnosno sposobnost učenja. Ta je mogućnost osigurana činjenicom da su univerzalne akcije učenja generalizirane radnje koje generiraju široku orijentaciju učenika u različitim predmetnim područjima znanja i motivacije za učenje.
Da bi znanje učenika bilo rezultat vlastitih traženja, potrebno je ta pretraživanja organizirati, upravljati, razvijati. kognitivna aktivnost. Doprinoseći formiranju kritičkog mišljenja kod učenika, aktivnosni pristup omogućuje implementaciju didaktičkih načela koja su formirana u sustavu razvojnog obrazovanja. Koristeći osnovna načela razvojnog odgoja, u praksi se može osloniti na osnovni model Agapova I.G., koji razlikuje sljedeće faze nastave kemije:
1. Izazov. Ažuriranje znanja.
2. Razumijevanje. Iskaz odgojnog zadatka. Otkrivanje novih znanja. Izrada algoritma. Primarno pričvršćivanje.
3. Refleksija. Samostalan rad- Samo kontrola. Zapravo refleksija.
Prvo -faza poziva ; sastoji se u ažuriranju i generalizaciji postojećeg znanja o temi koja se proučava, pobuđivanju interesa za nju, motiviranju učenika na aktivno učenje.
U drugoj fazi -faze razumijevanja - zadaci su različiti: dobivanje novih informacija, njihovo razumijevanje i korelacija s vlastitim znanjem.
Završna faza -faza kontemplacije i promišljanja , podrazumijeva cjelovito razumijevanje, prisvajanje i generaliziranje dobivenih informacija, razvijanje vlastitog stava prema gradivu koje se proučava, prepoznavanje još nepoznatog - pitanja i problema za daljnji rad ("novi izazov"), analizu cjelokupni proces proučavanja gradiva.
Što ova tehnologija daje studentima? Prvo, povećava se odgovornost za kvalitetu vlastitog obrazovanja. Drugo, razvijaju se vještine rada s tekstovima bilo koje vrste i s velikim količinama informacija. Treće, formiraju se kreativne i analitičke sposobnosti, sposobnost učinkovitog rada zajedno s drugim ljudima.
Tehnologija razvoja kritičkog mišljenja najučinkovitija je pri proučavanju gradiva od kojeg se može sastaviti zanimljiv, informativan tekst. Moguće je nekoliko oblika (strategija) primjene ove tehnologije: „Čitanje teksta s bilješkama“, „Popunjavanje tablice ZKhU (znam, želim znati, naučio sam)“, „Cik-cak“, „Napredno predavanje“.
Pozitivne strane predložena tehnologija: samostalno stjecanje znanja, razumijevanje vlastite aktivnosti u obrazovnom procesu, povećanje odgovornosti učenika. Moguće je organizirati praktičnu nastavu i proučavati novo gradivo. Poteškoća je u neujednačenom tempu čitanja i izvođenja pisanih radova učenika.
Ciljevi lekcije: formiranje predodžbi o najvažnijim polisaharidima: škrobu i celulozi – u usporedbi njihove strukture, svojstava, primjene i značaja u prirodi.
Zadaci: 1) obrazovne - konsolidirati sposobnost pisanja reakcija koje karakteriziraju kemijska svojstva monosaharida koristeći glukozu kao primjer; usporediti strukturu i svojstva škroba i celuloze;na temelju interdisciplinarnih veza organske kemije i biologije pokazati važnost polisaharida u strukturi i funkcioniranju divljači;
2) razvijanje - razvoj kognitivni interes kemiji i biologiji, razvijanje sposobnosti uspoređivanja, razvrstavanja, utvrđivanja bitnih obilježja, generaliziranja proučavanih svojstava i donošenja argumentiranih zaključaka; formiranje sposobnosti uspostavljanja uzročno-posljedičnih veza,samostalnost učenika u stjecanju i primjeni znanja; razvijanje praktičnih vještina u procesu izvođenja laboratorijskih pokusa.
3) obrazovne - promicati odgoj društvenosti, sposobnost komuniciranja na poslovnoj razini, prilagodbu rada u grupi, paru; širenje vidika učenika o uporabi polisaharida i njihovoj ulozi u prirodi.
Oprema: škrob, tinktura joda, otopineNaOH, CuSO 4 , H 2 TAKO 4 , epruvete, povećalo, demonstracijski uzorci: krumpir, bijeli kruh, brašno, tjestenina, riža, grah, vata, pamučna tkanina, uzorci tkanina od acetatnih vlakana, kompjuter.
Vrsta lekcije: Sat učenja novog gradiva.
TIJEKOM NASTAVE
II. Faza poziva
Uvod učitelji
Ulijte jak čaj
Prilično saharoza
Promiješajte u posudi žlicom.
glukoza iz grožđa,
I med fruktozu
I mliječna laktoza
Obožavaju odrasli i djeca.
Ali škrob i vlakna
Što je vrlo, vrlo nezaslađeno,
Nećete nas ni iznenaditi.
Takva je priroda
Ovo je također ... Ugljikohidrati(odgovor učenika)
Danas u lekciji, kao što ste shvatili iz pjesme, nastavljamo proučavati klasu organskih spojeva - ugljikohidrata.
(Čuvar zaslona - škrob i celuloza). Od trenutka kada se pojavi na Zemlji, osoba konzumira biljnu hranu bogatu škrobom, koristi drvo i druge biljne predmete koji sadrže veliki broj celuloza. Trenutno osoba već zna kako izolirati i obraditi prirodne polimere, dobivajući od njih vrijedne tvari, materijale, proizvode: papir i tkanine, brašno i melasu, alkohol i drveni ugljen.
- Dakle, koja je svrha lekcije? (zajedno sa studentima)
Postavljanje ciljeva: razmotriti najvažnije polisaharide: strukturu, svojstva, primjenu i značenje u prirodi i za čovjeka.
III. Ažuriranje osnovnih znanja.
Test
Od navedenih tvrdnji odaberite samo one koje su istinite:
I v a r i a n t - za monosaharide;
II varijanta – za polisaharide.
1. Njihovi predstavnici su glukoza, fruktoza, galaktoza, riboza, deoksiriboza.
2. Njihovi predstavnici su škrob, glikogen, dekstrini, celuloza, hitin.
3. Molekule se sastoje od mnogih identičnih ponavljajućih skupina atoma.
4. Dijele se na trioze, tetroze, pentoze, heksoze.
5. Imati opću formulu (C 6 H 10 OKO 5 ) n .
6. Molarna masa je mala i obično ne prelazi nekoliko stotina g/mol.
7. Molarna masa je velika i može doseći nekoliko milijuna g/mol.
8. Ne ulaziti u reakciju hidrolize.
9. sposoban za hidrolizu.
10. Molekulski ostaci nekih od njih dio su nukleotida DNA i RNA.
Odgovori. I opcija: 1, 4, 6, 8, 10; II opcija: 2, 3, 5, 7, 9.
Učenici polažu test, a zatim provjeravaju u parovima.
ja V . Faza razumijevanja
Učitelj poziva učenike da rade kroz tekst koristeći posebne oznake olovkom:
"V" - znam ovo;
"+" - nova informacija;
"-" - informacije koje su u suprotnosti s mojim saznanjima;
"?" – informacije koje zahtijevaju objašnjenje;
"!" - ovo je zanimljivo.
Učenici rade u grupama od 2 osobe, razmjenjuju mišljenja o problematici koja se proučava, pomažu jedni drugima u prevladavanju poteškoća koje nastaju, dajući potrebna objašnjenja.
dodatak
Škrob, njegova struktura, kemijska svojstva, primjena.
1. Fizička svojstva
To je bijeli prah, netopiv u hladnoj vodi i stvara koloidnu otopinu (škrobnu pastu) u vrućoj vodi. Postoji u dva oblika: amiloza - linearni polimer, topiv u vrućoj vodi, amilopektin - razgranati polimer, netopljiv u vodi, samo bubri.
2. Biti u prirodi
Škrob - glavni izvor rezervne energije u biljnim stanicama - nastaje u biljkama tijekom fotosinteze i akumulira se u gomoljima, korijenima, sjemenkama:
6 CO 2 + 6 H 2 O svjetlost, klorofil → C 6 H 12 O 6 + 6 O 2
nC 6 H 12 O 6 → (C 6 H 10 O 5 ) n + nH 2 O
glukoza škrob
Sadrži u gomoljima krumpira, žitaricama pšenice, riže, kukuruza.
Glikogen (životinjski škrob) proizvodi se u jetri i mišićima životinja.
3. Struktura
Sastoji se od ostataka α-glukoze.

škrob sadrži:
· amiloza ( unutarnji dioškrobno zrno) - 10-20%
· amilopektin (ljuska škrobnog zrna) - 80-90%
Lanac amiloza uključuje 200 - 1000 α-glukoznih ostataka i ima nerazgrananu strukturu.

amilopektin sastoji se od razgranatih makromolekula, čija molekularna težina doseže 1 - 6 milijuna.

Amiloza i amilopektin hidroliziraju se pod djelovanjem kiselina ili enzima u glukozu, koja služi kao izravan izvor energije za stanične reakcije, dio je krvi i tkiva te sudjeluje u metaboličkim procesima. Stoga je škrob neophodna rezerva ugljikohidrata u hrani.
Izgrađen poput amilopektinaglikogen (životinjski škrob), čije su makromolekule više razgranate:

4. Primjena
Škrob se široko koristi u raznim industrijama (prehrambena, fermentacijska, farmaceutska, tekstilna, papirna itd.).
· Vrijedan prehrambeni proizvod.
· Za uštirkanje platna.
· Kao dekstrinsko ljepilo.
5. Kemijska svojstva polisaharida
Hidroliza:
(C 6 H 10 O 5 ) n + nH 2 O t , H 2 TAKO 4 → nC 6 H 12 O 6
glukoza
Hidroliza se odvija u koracima:
(C 6 H 10 O 5 ) n → (C 6 H 10 O 5 ) m → xC 12 H 22 O 11 → nC 6 H 12 O 6 (Bilješka, m < n )
škrobni dekstrini maltoza glukoza
Kvalitativni odgovor:
Ohlađena škrobna pasta + ja 2 (otopina) = plava boja koja nestaje zagrijavanjem.
Makromolekula amiloze je spirala čiji se svaki zavoj sastoji od 6 jedinica α-glukoze.

Kada amiloza stupi u interakciju s jodom u vodenoj otopini, molekule joda ulaze u unutarnji kanal spirale, tvoreći tzv. omogućiti vezu. Ova veza ima karakteristiku plava boja. Ova reakcija se koristi u analitičke svrhe za otkrivanje škroba i joda (test škrob joda).
Celuloza, njena struktura i kemijska svojstva. Upotreba celuloze.
Celuloza (vlakna) je biljni polisaharid, koji je najčešća organska tvar na Zemlji.
1. Fizička svojstva
Ova tvar bijela boja, bez okusa i mirisa, netopiv u vodi, vlaknaste strukture. Otapa se u otopini amonijaka bakrenog hidroksida (II) - Schweitzerov reagens.
2. Biti u prirodi
Ovaj biopolimer ima visoku mehaničku čvrstoću i djeluje kao potporni materijal za biljke, tvoreći stijenku biljnih stanica. Velika količina celuloze nalazi se u drvenim tkivima (40-55%), u lanenim vlaknima (60-85%) i pamuku (95-98%). Glavni komponenta membrane biljnih stanica. Nastaje u biljkama tijekom fotosinteze.
Drvo se sastoji od 50% celuloze, a pamuk i lan, konoplja su gotovo čista celuloza.
Hitin (analog celuloze) je glavna komponenta vanjskog kostura člankonožaca i drugih beskralježnjaka, kao i u staničnim stijenkama gljivica i bakterija.
3. Struktura
Sastoji se od ostataka β-glukoze
![]()
4. Potvrda
Dobiven od drveta
5. Primjena Celuloza se koristi u proizvodnji papira, umjetnih vlakana, filmova, plastike, boja i lakova, bezdimnog praha, eksploziva, krutog raketnog goriva, za dobivanje hidrolitičkog alkohola itd.
· Dobivanje acetatne svile - umjetno vlakno, pleksiglas, negorivi film od celuloznog acetata.
· Dobivanje bezdimnog praha od triacetilceluloze (piroksilina).
· Dobivanje kolodija (gustog filma za lijek) i celuloida
(proizvodnja filmova, igračaka) od diacetilceluloze.
· Proizvodnja niti, užadi, papira.
· Dobivanje glukoze, etilnog alkohola (za proizvodnju gume)
Najvažniji derivati celuloze su:
-
metilceluloze
(celulozni metil eteri) opće formule
N( x= 1, 2 ili 3);
- celulozni acetat (celulozni triacetat) - ester celuloze i octene kiseline n
- nitroceluloze (celulozni nitrati) - esteri celuloznog nitrata: n ( x= 1, 2 ili 3).
6. Kemijska svojstva
Hidroliza
(C 6 H 10 O 5 ) n + nH 2 O t , H 2 TAKO 4 → nC 6 H 12 O 6
glukoza
Hidroliza se odvija u koracima :
(C 6 H 10 O 5 ) n → (C 6 H 10 O 5 ) m → xC 12 H 22 O 11 → n C 6 H 12 O 6 ( Bilješka , m
škrobni dekstrini maltoza glukoza
Reakcije esterifikacije
Celuloza je polihidrični alkohol; postoje tri hidroksilne skupine po jediničnoj stanici polimera. U tom smislu, celulozu karakteriziraju reakcije esterifikacije (formiranje estera). Od najveće su praktične važnosti reakcije s dušičnom kiselinom i anhidridom octene kiseline. Celuloza ne daje reakciju "srebrnog zrcala".
1. Nitracija:
(C 6 H 7 O 2 (Oh) 3 ) n + 3 nHNO 3 H 2 TAKO 4(konc.)→ (C 6 H 7 O 2 (ONO 2 ) 3 ) n + 3 nH 2 O
piroksilin

celuloza
3n HNO 3
H2SO4 →

celulozni trinitrat
3n H 2 O
Potpuno esterificirano vlakno poznato je kao piroksilin, koje se nakon odgovarajuće obrade pretvara u bezdimni prah. Ovisno o uvjetima nitriranja može se dobiti celulozni dinitrat koji se u tehnici naziva koloksilin. Također se koristi u proizvodnji baruta i čvrstih goriva. Osim toga, celuloid se pravi na bazi koloksilina.
2. Interakcija sa octena kiselina:
(C 6 H 7 O 2 (OH) 3 ) n + 3nCH 3 COOH H2SO4( konc .)→ (C 6 H 7 O 2 (OCOCH 3 ) 3 ) n + 3 nH 2 O
Kada celuloza reagira s anhidridom octene kiseline u prisutnosti octene i sumporne kiseline, nastaje triacetilceluloza.


triacetilceluloza
3n CH3COOH
triacetilceluloza ( ili acetat celuloze) je vrijedan proizvod za proizvodnju nezapaljivog filma iacetatna svila . Za to se acetat celuloze otopi u smjesi diklormetana i etanola, te se ta otopina provlači kroz predilne mreže u mlaz toplog zraka.
A sama kocka shematski izgleda ovako:

1 - otopina za predenje,
2 - umrijeti,
3 - vlakna.
Otapalo isparava i mlazovi otopine pretvaraju se u najtanje niti acetatne svile.
Govoreći o upotrebi celuloze, ne može se ne reći da se velika količina celuloze troši za proizvodnju raznih papira.Papir - Ovo je tanak sloj vlaknastih vlakana, zalijepljen i prešan na posebnom stroju za papir.
V . Faza refleksije i refleksije
Učenici izrađuju tablicu o karakteristikama škroba i celuloze (tablica). Istovremeno u svakom paru jedan učenik popunjava kolonu o škrobu, a drugi o celulozi, nakon čega se razmjenjuju rezultati.
stol
Karakteristično
Polisaharid
Škrob
Celuloza
Molekularna formula
Strukturne značajke
Strukturna poveznica
Stupanj polimerizacije
Molekulska masa
Struktura makromolekula
Biti u prirodi
biološke funkcije
Fizička svojstva
Kemijska svojstva
Priznanica
Primjena
VI. Sažimanje lekcije. Odraz.
Što vam je bilo najzanimljivije?
Čega se najviše sjećate?
Što je uzrokovalo poteškoću?
Što je iznenadilo?
Funkcije ugljikohidrata (poruka učenika)
1. Energija - ugljikohidrati služe kao izvorenergije za tijelo. Pri oksidaciji 1 g ugljikohidrataOslobađa se 17,6 kJ (4,2 kcal) energije. Treba napomenuti da su šećeri glavni izvor postamobilizirana energija, budući da je u procesu probaveniya, lako se pretvaraju u oblik pogodan zazadovoljiti energetske potrebe stanica.
2.Gradnja - celuloza je diostanične stijenke biljaka, hitin se nalazi uu staničnoj stijenci gljiva i u vanjskom kosturu člankonožaca, glikoproteini - spojevi ugljikohidrata s bjelančevinama dio su hrskavice i koštanog tkiva životinja.
3. Skladištenje – izražava se u činjenici da škrob akumuliraju biljne stanice, a glikogen – životinjske stanice. Ove tvari služe kao izvor glukoze za stanice i organizme, koja se prema potrebi lako oslobađa.
4. Zaštitni - heparin - inhibitor zgrušavanja krvi; sluz koju luče razne žlijezde i bogata ugljikohidratima štiti jednjak, crijeva, želudac, bronhije od mehanička oštećenja, spriječiti prodor bakterija i virusa u tijelo; gume oslobođene na mjestima oštećenja debla i grana štite drveće i grmlje od prodora infekcija kroz rane.
5. Komponenta vitalnih tvari – zajedno s proteinima, dio su enzima, DNK, RNA, ATP.
Domaća zadaća. Dopunite tablicu recima "Primanje" i "Zahtjev" koristeći referentnu literaturu.
Karakterizacija škroba i celuloze
Karakteristično
Polisaharid
Škrob
Celuloza
Molekularna formula
(IZ 6 H 10 O 5 ) n
(IZ 6 H 10 O 5 ) n
Strukturne značajke
α- glukoza. Stupanj polimerizacije je od nekoliko stotina do nekoliko tisuća. Molarna masa doseže nekoliko stotina tisuća g/mol. Građa makromolekula: linearna (amiloza) i razgranata (amilopektin). U škrobu amiloza čini 10-20%, a amilopektin 80-90%
Strukturna jedinica - ostatak cikličke molekuleβ -glukoza. Stupanj polimerizacije je od nekoliko tisuća do nekoliko desetaka tisuća. Molarna masa doseže nekoliko milijuna g/mol. Građa makromolekula: linearna
Položaj u prirodi i biološke funkcije
U citoplazmi biljnih stanica u obliku zrna rezerve hranjiva. Sadržaj (težinski): u riži - do 80%, u pšenici i kukuruzu - do 70%, u krumpiru - do 20%
Obvezni element stanične stijenke biljaka, koji obavlja građevinsku, strukturnu funkciju. Sadržaj (težinski): u pamučnim vlaknima - do 95%, u vlaknima lana i konoplje - do 80%, u drvu - do 50%
Fizička svojstva
Bijeli amorfni prah, ne otapa se u hladnoj vodi, bubri u vrućoj i stvara koloidnu otopinu - škrobnu pastu (istovremeno se amiloza, kao sastavni dio škroba, otapa u vrućoj vodi, a amilopektin samo bubri)
Čvrsta vlaknasta tvar, netopiva u vodi
Kemijska svojstva
(IZ 6 H 10 O 5 ) n + n H 2 O ->n IZ 6 H 12 O 6 .
2) Stvaranje estera zbog hidroksi skupina (nema praktičnog značaja).
3) Kvalitativna reakcija s jodom - plava boja
1) Stvaranje glukoze kao rezultat potpune hidrolize:
(IZ 6 H 10 O 5 ) n + n H 2 O ->n IZ 6 H 12 O 6 .
2) Stvaranje estera zbog hidroksi skupina: pri interakciji s dušičnom kiselinom (u prisutnosti sumporne kiseline) - mononitrati, dinitrati i trinitrati; pri interakciji s octenom kiselinom (ili anhidridom octene kiseline) - diacetati i triacetati. Svi esteri imaju široku primjenu.
3) Ne reagira s jodom
Škrob (S6N10O5) n je polisaharid koji se sastoji od dvije frakcije: 25% linearne amiloze i 75% razgranatog amilopektina. Nastaje na svjetlu u biljkama u
Ova tvar je bijeli prah koji se ne otapa u hladnoj vodi, stvarajući suspenziju. Nakon taloženja suspenzije, bijeli se talog taloži na dnu spremnika, a voda se lako može isprazniti. Nakon sušenja škrob vraća sva svoja svojstva.
U vrućoj vodi ova tvar stvara koloidnu otopinu - to je takva ljepljiva tekućina, koja se također naziva škrobna pasta i često se koristi u svakodnevnom životu kao ljepilo. I na tom svojstvu temelji se priprema želea i nekih slastica.
Škrob je kemijski inertna tvar. Da bi on reagirao, potrebno je sudjelovati u tom procesu katalizatora.
Upotreba ove tvari temelji se na njezinim fizikalnim i kemijskim svojstvima. Stoga se škrob i njegovi derivati često koriste u prehrambenoj, tekstilnoj i papirnoj industriji. A za žive organizme igra važnu ulogu.
Za korištenje ovoga organska tvar u industrijske svrhe podvrgava se kemijskom napadu. Hidroliza škroba je proces izmjene između iona tvari i vode, koji može biti enzimski ili kiseli.
Kemijska hidroliza škroba je katalitička reakcija, jer se događa zagrijavanjem u prisutnosti anorganskih kiselina. Tijekom toga nastaje glukoza, što se može izraziti jednadžbom:
(S6N10O5) n + nH2O + (kat. H2SO4 + t °) = nC6H12O6.
Ali u U posljednje vrijeme enzimska hidroliza škroba postaje sve popularnija. Posebnim tehnologijama iz njega se dobivaju melasa i glukoza na isti način kao u kemijskoj hidrolizi.
Prednost ovog procesa je u tome što se kao polazni materijal za njega uzimaju biljke koje sadrže škrob, kao što su raž, krumpir, kukuruz, riža i neke druge. Ti izvori, osim toga, sadrže amilolitičke enzime, koji se koriste u procesu hidrolize.
Na primjer, takvi enzimi su izoamilaza i pululanaza, glukolinaza. Enzimi su prirodni katalizatori koji ubrzavaju stvari. kemijske reakcije. Shematski, proces razgradnje škroba pod djelovanjem enzima izgleda ovako: škrob → topljivi škrob (amiloza) → oligosaharidi (dekstrini) → disaharid (maltoza = slad) → α-glukoza. Također se može izraziti jednadžbom:
(C6H10O5)n + nH2O + (kat.-enzim) = nC6H12O6
Jasno možete vidjeti da je došlo do kemijske hidrolize provođenjem eksperimenta. Zakuhajte smjesu škrobne paste sa sumpornom kiselinom. Provjeravamo da li je došlo do hidrolize - ukapamo jod. Ako je reakcija negativna, odnosno nema plave ili ljubičaste boje, tada je došlo do hidrolize.
Sada dokazujemo da je proizvod hidrolize glukoza. Dobivenoj otopini dodamo lužinu i (II) (CuSO4). Talog ne ispada, otopina poprima svijetlo plavu boju. Zagrijemo ga i vidimo stvaranje taloga boje terakote (cigle) - to znači da se u otopini nalazi glukoza koja je nastala tijekom hidrolize.
Enzimska hidroliza škroba također se događa u ljudskom tijelu. Ovaj proces je vrlo važan, jer u njemu nastaju ugljikohidrati, posebice glukoza. Oksidira se u svakoj stanici tijela, stvarajući vodu i ugljični dioksid, a pritom oslobađa energiju koja je neophodna za normalno funkcioniranje organizma.
Hidroliza škroba uz pomoć enzima počinje žvakanjem hrane. Ljudska slina sadrži enzim – amilazu, pod čijim se djelovanjem škrob razgrađuje na jednostavnije komponente – dekstrine. Taj se proces može čak i osjetiti. Uostalom, ako dugo žvačete kruh, tada se u ustima pojavljuje slatkasti okus, što ukazuje da je započeo proces hidrolize škroba. Višak glukoze, koji nastaje tijekom hidrolize, taloži se u jetri u obliku rezervne hranjive tvari – glikogena.
Tema 4. KOJI SADRŽE KISIKORGANSKI SPOJEVI
Lekcija 46
Tema lekcije. Škrob. Struktura škroba. Kemijska svojstva: hidroliza, reakcija s jodom
Ciljevi sata: proširiti znanja učenika o visokomolekularnim organskim spojevima, njihovoj rasprostranjenosti u prirodi, građi i svojstvima na primjeru prirodnih polimera polisaharida – škroba; razvijati znanje učenika o kemijska struktura makromolekularni organski spojevi na primjeru polimerne strukture molekula škroba; upoznati kemijska svojstva škroba - reakciju polikondenzacije i hidrolize; pokazati njihovu važnost za život živih organizama i ljudi; proučavati kvalitativnu reakciju na škrob; otkriti odnos između svojstava, strukture i upotrebe škroba.
Vrsta sata: kombinirani sat svladavanja znanja, vještina i sposobnosti i njihove kreativne primjene u praksi.
Oblici rada: frontalni rad, edukativno predavanje, heuristički razgovor, laboratorijski rad, demonstracijski pokus.
Demonstracija 13. Hidroliza škroba.
Laboratorijsko iskustvo 12. Interakcija škroba s vodom.
Laboratorijski pokus 13. Interakcija škroba s otopinom joda.
Oprema: multimedijalni dijagram strukture molekula škroba.
II. Ispitivanje domaća zadaća. Ažuriranje osnovnih znanja. Motivacija za aktivnosti učenja
Zadaci za razrednu raspravu su napisani ili projicirani na ploču.
1) Tri neobilježene numerirane epruvete sadrže otopine etanala, glukoze i saharoze. Pomoću pokusa odredite sadržaj svake od epruveta.
2) Zašto je pekmez slađi od šećera, iako se kuha sa šećerom? Svoj odgovor potkrijepi jednadžbom reakcije.
3) Napišite reakcijske jednadžbe pomoću kojih možete provesti transformacije: saharoza etanol.
4) Koje su tri klase ugljikohidrata?
5) Dokazati važnost reakcije fotosinteze za biljke.
6) Koja je biološka uloga ugljikohidrata?
III. Učenje novog gradiva
POLISAHARIDI: ŠKROB, CELULOZA
1. Priča učitelja
Najvažniji polisaharidi su škrob i celuloza (vlakna). Izgrađeni su od ostataka glukoze. Opća formula ovih polisaharida je (C6 H 10 O 5) n.
Elementarna karika lanca ima oblik:

Škrob je bijeli prah koji se sastoji od malih zrnaca, netopiv u hladnoj vodi. Kao rezultat obrade škroba toplom vodom, moguće je izolirati dvije frakcije: frakciju topljivu u toploj vodi, koja se sastoji od amiloznog polisaharida, i frakciju koja samo bubri u toploj vodi s stvaranjem paste i sastoji se od amilopektin polisaharid.
Škrob nastaje u biljkama tijekom fotosinteze i taloži se kao "rezervni" ugljikohidrat u korijenu, gomoljima i sjemenkama. Na primjer, zrna riže, pšenice, raži i drugih žitarica sadrže 60-80% škroba, gomolji krumpira - 15-20%. Sličnu ulogu u životinjskom carstvu ima polisaharid glikogen koji se "pohranjuje" uglavnom u jetri.
Molekula amilopektina izgrađena je slično, ali ima grananje u lancu, što stvara prostornu strukturu. Na točkama grananja, ostaci monosaharida su povezani (1-6)-glikozidnim vezama. Između točaka grananja obično ima 20-25 ostataka glukoze.
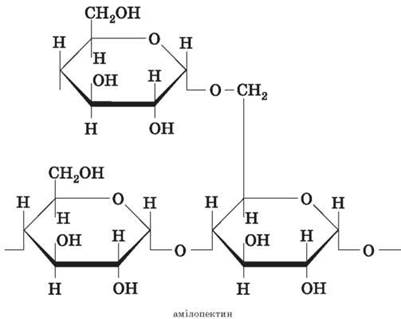
Glukoza nastaje kao rezultat fotosinteze, akumulira se u plodovima, lišću i stabljikama biljaka u obliku različitih polimera: škroba i celuloze.
♦ Navedite tvari koje sadrže veliku količinu škroba. (Riža, pšenica, krumpir, itd.)
Jednadžba za stvaranje škroba ili celuloze može se prikazati na sljedeći način:
nC 6H 12O 6 (C 6H 10O 5)n + nH 2O
Ova reakcija se naziva reakcija polikondenzacije, monomer je glukoza, polimer je celuloza ili škrob, nusprodukt je voda.
Škrob je mješavina dva polisaharida koja se sastoji od cikličkih ostataka α-glukoze.

škrob sadrži:
Amiloza (unutarnji dio škrobnog zrna) - 10-20%;
Amilopektin (ljuska škrobnog zrna) - 80-90%.
Lanac amiloze uključuje 200-1000 ostataka α-glukoze (prosječna molekularna težina - 160 000) i ima neprekinutu strukturu.

Jedinice α-glukoze "uvijaju" makromolekulu u spiralu. To smanjuje vjerojatnost stvaranja interlantnih H-veza, ali povećava mogućnost takvih veza s molekulama vode. Zbog toga se amiloza otapa u vodi.
Makromolekula amiloze je spirala čiji se svaki zavoj sastoji od šest jedinica α-glukoze.

U procesu interakcije amiloze s jodom u vodenoj otopini, molekule joda ulaze u unutarnji kanal spirale, tvoreći takozvani inkluzijski spoj, koji ima karakterističnu plavu boju. Ova reakcija se koristi u analitičke svrhe za otkrivanje škroba i joda (test škrob joda).
Amilopektin se sastoji od razgranatih makromolekula čija molekularna težina doseže 1-6 milijuna.

Za razliku od amiloze, amilopektin ima razgranatu strukturu. Na točkama grananja veze su povezane zbog eliminacije vode iz α - OH i CH 2 - OH skupina.
Poput amilopektina, gradi se i glikogen (životinjski škrob) čije se makromolekule odlikuju značajnom grananjem.
Reakcija interakcije škroba i celuloze s vodom - hidroliza, događa se zagrijavanjem u kiseloj sredini ili pod djelovanjem enzima.
Demo 13 - Hidroliza škroba (u prisutnosti sumporne kiseline)
2. Kemijska svojstva škroba
Škrob se lako hidrolizira: u procesu zagrijavanja u prisutnosti sumporne kiseline nastaje glukoza.
Ovisno o reakcijskim uvjetima, hidroliza se može provesti u fazama s stvaranjem međuprodukata.
Kvalitativna reakcija na škrob je njegova interakcija s jodom: uočava se intenzivna plava boja. Takvo bojenje se pojavljuje ako se otopina joda kapne na krišku krumpira ili krišku bijelog kruha.
Škrob ne ulazi u reakciju "srebrnog zrcala".
Škrob je vrijedan prehrambeni proizvod. Kako bi se olakšala asimilacija škroba, proizvodi koji ga sadrže termički se obrađuju, odnosno kuhaju se krumpir i žitarice, peče kruh. Procesi dekstrinizacije (tvorba dekstrina), dok se odvijaju, pridonose boljoj apsorpciji škroba u tijelu i njegovoj naknadnoj hidrolizi u glukozu.
U Industrija hraneškrob se koristi u proizvodnji kobasica, slastica i kulinarskih proizvoda. također se koristi za proizvodnju glukoze, u proizvodnji papira, tekstila, ljepila, lijekovi itd.
IV. Primarna primjena stečenog znanja
Vođena praksa
Laboratorijski pokus 12. Interakcija škroba s vodom
U hladnoj vodi otopite prstohvat škroba. Što vidimo?
Polako, pridržavajući se sigurnosnih mjera opreza i pravila grijanja, zagrijte sadržaj epruvete.
Laboratorijsko iskustvo 13
U dobivenu pastu dodajte dvije ili tri kapi razrijeđene otopine joda. Što vidimo?
Pojava ljubičasto-plave boje ukazuje na prisutnost škroba u otopini.
Zaključak - djelovanje joda je kvalitativna reakcija na prisutnost škroba u tvari.
V. Vježbe treninga
Grupni zadaci
Svaka grupa ispunjava zadatak i predstavlja ga razredu na raspravu.
Zadatak 1. Izračunajte količinu škroba koja nastaje kao rezultat fotosinteze ako biljke pri tom procesu ispuste 10 tona kisika.
Zadatak 2. Dvije epruvete sadrže škrob i glukozu. Kako uz pomoć iskustva prepoznati te tvari?
Zadatak 3. Nitroceluloze – produkti interakcije celuloze i dušične kiseline, izrazito su zapaljivi. Trinitroceluloza (piroksilin) je eksploziv koji se koristi u proizvodnji bezdimnog baruta. Tijekom eksplozije odvija se proces raspadanja. Zapišite jednadžbu reakcije:
![]()
Zadatak 4. Razmislite zašto se vlakna mogu dobiti iz celuloze, ali ne i iz škroba.
VI. Sažimanje lekcije
♦ Koje ste nove pojmove naučili danas na satu?
♦ Koje su za vas praktične implikacije onoga što ste danas naučili?
Sumirajući sat, ocjenjuje rad učenika na satu.
VII. Domaća zadaća
Razradite materijal odlomka, odgovorite na pitanja u vezi s njim, odradite vježbe.
Kreativna aktivnost: Ispitajte škrob u raznim namirnicama i napišite izvješće.
