Крахмал. Нахождение в природе, практическое значение, гидролиз крахмала.
Крахмал образуется в растениях при фотосинтезе и откладывается в корнях и семенах. Он представляет собой белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор в горячей воде.
Крахмал - это природный полимер, образованный остатками α-глюкозы и выглядит следующим образом:
Комплекс крахмала и йода имеет характерное синее окрашивание. Эта реакция служит для обнаружения крахмала.
Химические свойства. При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Эта реакция имеет важное промышленное значение, поскольку из глюкозы получают этанол, молочную кислоту и другие ценные продукты.
Крахмал - это ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Сплавы железа.
Железо находится в побочной подгруппе VIII группы периодической системы. Электронная формула атома железа:
![]()
Типичные степени окисления железа +2 и +3. Степень окисления +2 проявляется за счет потери двух 4s-электронов. Степень окисления +3 соответствует также при потере еще одного Зd-электрона, при этом Зd-уровень оказывается заполненным наполовину; такие электронные конфигурации относительно устойчивы.
Физические свойства. Железо – типичный металл, образует металлическую кристаллическую решетку. Железо проводит электрический ток, довольно тугоплавоr, температура плавления 1539°С. От большинства других металлов железо отличается способностью намагничиваться.
Химические свойства .
Железо реагирует со многими неметаллами:
![]()
Образуется железная окалина – смешанный оксид железа. Его формулу записывают также так: FeО Fe 2 О 3 .
![]()
Реагирует с кислотами с выделением водорода:
Вступает в реакции замещения с солями металлов, расположенных правее железа в ряду напряжений:
Соединения железа. FeО - основной оксид, реагирует с растворами кислот с образованием солей железа (II). Fe 2 О 3 - амфотерный оксид, реагирует также с рас творами щелочей.

Гидроксиды железа. Fe(ОН) 2 - типичный основной оксид, Fe(ОН) 3 обладает амфотерными свойствами, реагирует не только с кислотами, но и с концентрированными растворами щелочей.

Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом воздуха:
При реакции солей железа (II) и (III) со щелочами в осадок выпадают нерастворимые гидроксиды:
Сплавы железа . Современная металлургическая промышленность производит железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К первой группе относятся различные сорта чугуна, ко второй - различные сорта стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокатывать, волочить, штамповать. Различие в механических свойствах чугунов и сталей зависит прежде всего от содержания в них углерода - в чугунах содержится около 4% углерода, а в сталях - обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из чугуна - сталь. Чугун выплавляют в доменных печах, сталь варят в сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в стали.
Чугун. Чугун, предназначенный для переработки в сталь, называют передельным чугуном. Он содержит от 3,9 до 4,3% С, 0,3-1,5% Si, 1,5-3,5% Мn, не более 0,3% Р и не более 0,07% S. Чугун, предназначенный"для получения отливок, называется литейным чугуном, В доменных печах выплавляются также ферросплавы, применяемые преимущественно в производстве сталей в качестве добавок. Ферросплавы имеют, по сравнению с передельным чугуном, повышенное содержание кремния (ферросилиций), марганца (ферромарганец), хрома (феррохром) и других элементов.
Стали. Все стали делятся на углеродистые и легированные.
Углеродистые стали содержат в несколько раз меньше углерода, кремния и марганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистой стали зависят прежде всего от содержания в ней углерода: чем больше в стали углерода, тем она твёрже. Промышленность производит мягкие стали, стали средней твёрдости и твёрдые. Мягкие стали и стали средней твёрдости применяются для изготовления деталей машин, труб, болтов, гвоздей и т. д., а твёрдые стали-для изготовления инструментов.
В сталях должно быть возможно меньше серы и фосфора, так как эти примеси ухудшают механические свойства сталей. В повышенных количествах сера вызывает красноломкость - образование трещин при горячей механической обработке металла. Фосфор вызывает хладноломкость-хрупкость стали при обыкновенной температуре. -
Легированные стали. Физические, химические и механические свойства сталей существенно изменяются от введения в их состав повышенного количества марганца и кремния, а также хрома, никеля, вольфрама и других элементов. Эти элементы называются легирующими, а стали - легированными [от латинского слова ligare – связывать, соединять].
Наиболее широко в качестве легирующего элемента применяется хром. Особенно большое значение для сооружения машин, аппаратов и многих деталей машин имеют хромоникелевые стали. Эти стали обладают высокой пластичностью, прочностью, жаростойкостью и стойкостью к действию окислителей. Азотная кислота любой концентрации не разрушает их даже при температурах кипения. Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие, серебристого цвета, листы хромоникелевой стали украшают арки станции «Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи, ложки, вилки и другие предметы домашнего обихода.
Молибден и ванадий повышают твёрдость и прочность сталей при повышенных температурах и давлениях. Так, хромомолибденовые и хромованадиевые стали применяются для изготовления трубопроводов и деталей компрессоров в производстве синтетического аммиака, авиационных моторов.
При резании с большой скоростью инструмент сильно разогревается и быстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется и при повышенных температурах. Поэтому хромовольфрамовые стали применяются для изготовления режущих инструментов, работающих при больших скоростях.
Увеличение содержания в стали марганца повышает её сопротивление трению и удару. Марганцовистые стали применяются для изготовления железнодорожных скатов, стрелок, крестовин, камнедробильных машин.
Применение легированных сталей позволяет значительно снизить вес металлических конструкций, повысить их прочность, долговечность и надёжность в эксплуатации.
Крахмал и целлюлоза – представители природных полимеров. Нахождение в природе. Свойства, применение.
Урок с использованием технологии развития критического мышления 11 класс
Системно-деятельностный подход позволяет выделить основные результаты обучения и воспитания в контексте ключевых задач и универсальных учебных действий, которыми должны владеть учащиеся.
Овладение учащимися универсальными учебными действиями создают возможность самостоятельного успешного усвоения новых знаний, умений и компетентностей, включая организацию усвоения, то есть умения учиться. Эта возможность обеспечивается тем, что универсальные учебные действия – это обобщенные действия, порождающие широкую ориентацию обучающихся в различных предметных областях познания и мотивацию к обучению.
Для того чтобы знания обучающихся были результатом их собственных поисков, необходимо организовать эти поиски, управлять, развивать их познавательную деятельность. Способствуя формированию критического мышления у учащихся, деятельностный подход позволяет реализовать дидактические принципы, которые сформировались в системе развивающего обучения. Используя основные принципы развивающего обучения, можно опираться в практике на базовую модель Агапова И.Г., выделяющего следующие стадии урока при обучении химии:
1. Вызов. Актуализация знаний.
2. Осмысление. Постановка учебной задачи. Открытия нового знания. Составление алгоритма. Первичное закрепление.
3. Рефлексия. Самостоятельная работа - самоконтроль. Собственно рефлексия.
Первая – стадия вызова ; она заключается в актуализации и обобщении имеющихся знаний по изучаемой теме, возбуждении интереса к ней, мотивации учащихся к активной учебной деятельности.
На второй стадии – стадии осмысления – задачи другие: получение новой информации, ее осмысление и соотнесение с собственными знаниями.
Заключительная стадия – стадия размышления и рефлексии , подразумевающая целостное осмысление, присвоение и обобщение полученной информации, выработку собственного отношения к изучаемому материалу, выявление еще не познанного – вопросов и проблем для дальнейшей работы («новый вызов»), анализ всего процесса изучения материала.
Что дает учащимся эта технология? Во-первых, повышается ответственность за качество собственного образования. Во-вторых, развиваются навыки работы с текстами любого типа и с большими объемами информации. В-третьих, формируются творческие и аналитические способности, умение эффективно работать совместно с другими людьми.
Технология развития критического мышления наиболее эффективна при изучении материала, по которому может быть составлен интересный, познавательный текст. Возможны несколько форм (стратегий) применения этой технологии: «Чтение текста с пометками», «Заполнение таблицы ЗХУ (знаю, хочу узнать, узнал)», «Зигзаг», «Продвинутая лекция».
Положительные стороны предлагаемой технологии: самостоятельное добывание знаний, осмысление собственной деятельности в учебном процессе, повышение ответственности обучающихся. Возможна организация практического занятия и изучение нового материала. Сложность заключается в неодинаковом темпе чтения и оформления письменной работы учащимися.
Цели урока: формирование представлений о важнейших полисахаридах: крахмале и целлюлозе - в сравнении их строения, свойств, применения и значения в природе.
Задачи: 1) обучающие - закрепить умение писать реакции, характеризующие химические свойства моносахаридов на примере глюкозы; сравнить строение и свойства крахмала и целлюлозы; на основе межпредметных связей органической химии и биологии показать значение полисахаридов в строении и функционировании живой природы;
2) развивающие - развитие познавательного интереса к химии и биологии, выработка умений сравнивать, классифицировать, выделять существенные признаки, обобщать изучаемые свойства и делать аргументированные выводы; формирование умения устанавливать причинно- следственные связи, самостоятельности учащихся по добыванию и применению знаний; развитие практических умений и навыков в процессе выполнения лабораторных опытов.
3) воспитательные - способствовать воспитанию коммуникабельности, умению общаться на деловом уровне, адаптации работы в группе, паре; расширение кругозора обучающихся о применении полисахаридов и их роли в природе.
Оборудование: крахмал, йодная настойка, растворы NaOH , CuSO 4 , H 2 SO 4 ,пробирки, лупа, демонстрационные образцы: картофель, белый хлеб, мука, макароны, рис, фасоль, вата, хлопчатобумажная ткань, образцы тканей из ацетатного волокна, компьютер.
Тип урока: Урок изучения нового материала.
ХОД УРОКА
II. Стадия вызова
Вступительное слово учителя
Наливаешь крепкий чай,
Хорошенько сахарозу
В чашке ложкой размешай.
Виноградную глюкозу,
И медовую фруктозу,
И молочную лактозу
Любят взрослый и малыш.
Но крахмалом и клетчаткой,
Что совсем-совсем несладки,
Тоже нас не удивишь.
Так устроена природа –
Это тоже… УГЛЕВОДЫ
(отвечают учащиеся)
Сегодня на уроке, как вы поняли из стихотворения, мы продолжаем изучать класс органических соединений - углеводы.
(Заставка на экране – крахмал и целлюлоза). С момента своего появления на Земле человек употребляет растительную пищу, богатую крахмалом, использует для своих нужд древесину и другие растительные объекты, содержащие большое количество целлюлозы. В настоящее время человек уже умеет выделять и перерабатывать природные полимеры, получая из них ценные вещества, материалы, продукты: бумагу и ткани, муку и патоку, спирт и древесный уголь.
- Таким образом, какова цель урока? (совместно с учащимися)
Целеполагание: рассмотреть важнейшие полисахариды: строение, свойства, применение и значение в природе и для человека.
III. Актуализация опорных знаний.
Тест
Выберите из предложенных утверждений только те, которые справедливы:
I в а р и а н т – для моносахаридов;
II в а р и а н т – для полисахаридов.
1. Их представителями являются глюкоза, фруктоза, галактоза, рибоза, дезоксирибоза.
2. Их представителями являются крахмал, гликоген, декстрины, целлюлоза, хитин.
3. Молекулы состоят из множества одинаковых повторяющихся групп атомов.
4. Подразделяются на триозы, тетрозы, пентозы, гексозы.
5. Имеют общую формулу (С 6 Н 10 О 5 ) n .
6. Молярная масса невелика и обычно не превышает нескольких сотен г/моль.
7. Молярная масса велика и может достигать нескольких миллионов г/моль.
8. Не вступают в реакцию гидролиза.
9. Способны подвергаться гидролизу.
10. Остатки молекул некоторых из них входят в состав нуклеотидов ДНК и РНК.
Ответы. I вариант: 1, 4, 6, 8, 10; II вариант: 2, 3, 5, 7, 9.
Учащиеся выполняют тест, после чего осуществляют взаимную проверку в парах.
I V . Стадия осмысления
Учитель предлагает учащимся проработать текст, используя специальные пометки карандашом:
«V» – это я знаю;
«+» – новая информация;
«–» – информация, противоречащая моим знаниям;
«?» – информация, требующая пояснения;
«!» – это интересно.
Учащиеся работают в группах по 2человека, обмениваются мнениями по изучаемому вопросу, помогают друг другу преодолеть возникающие затруднения, делая необходимые пояснения.
Приложение
Крахмал, его строение, химические свойства, применение.
1. Физические свойства
Это белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
2. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
6 CO 2 + 6 H 2 O свет, хлорофилл → C 6 H 12 O 6 + 6 O 2
nC 6 H 12 O 6 → (C 6 H 10 O 5 ) n + nH 2 O
глюкоза крахмал
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
3. Строение
Состоит из остатков α - глюкозы.

В состав крахмала входят:
· амилоза (внутренняя часть крахмального зерна) – 10-20%
· амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.

Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 - 6 млн.

Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:

4. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
· Ценный питательный продукт.
· Для накрахмаливания белья.
· В качестве декстринового клея.
5. Химические свойства полисахаридов
Гидролиз:
(C 6 H 10 O 5 ) n + nH 2 O t , H 2 SO 4 → nC 6 H 12 O 6
глюкоза
Гидролиз протекает ступенчато:
(C 6 H 10 O 5 ) n → (C 6 H 10 O 5 ) m → xC 12 H 22 O 11 → n C 6 H 12 O 6 (Примечание, m < n )
крахмал декстрины мальтоза глюкоза
Качественная реакция:
Охлаждённый крахмальный клейстер + I 2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.

При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба).
Целлюлоза, ее строение и химические свойства. Применение целлюлозы.
Целлюлоза (клетчатка) – растительный полисахарид, являющийся самым распространенным органическим веществом на Земле.
1. Физические свойства
Это вещество белого цвета, без вкуса и запаха, нерастворимое в воде, имеющее волокнистое строение. Растворяется в аммиачном растворе гидроксида меди (II ) – реактиве Швейцера.
2. Нахождение в природе
Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%), в волокнах льна (60-85%) и хлопка (95-98%). Основная составная часть оболочки растительных клеток. Образуется в растениях в процессе фотосинтеза.
Древесина состоит на 50% из целлюлозы, а хлопок и лён, конопля практически чистая целлюлоза.
Хитин (аналог целлюлозы) – основной компонент наружного скелета членистоногих и других беспозвоночных, а также в составе клеточных стенок грибов и бактерий.
3. Строение
Состоит из остатков β - глюкозы
![]()
4. Получение
Получают из древесины
5. Применение Целлюлоза используется в производстве бумаги, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива, для получения гидролизного спирта и др.
· Получение ацетатного шёлка – искусственное волокно, оргстекла, негорючей плёнки из ацетилцеллюлозы.
· Получение бездымного пороха из триацетилцеллюлозы (пироксилин).
· Получение коллодия (плотная плёнка для медицины) и целлулоида
(изготовление киноленты, игрушек) из диацетилцеллюлозы.
· Изготовление нитей, канатов, бумаги.
· Получение глюкозы, этилового спирта (для получения каучука)
К важнейшим производным целлюлозы относятся:
-
метилцеллюлоза
(простые метиловые эфиры целлюлозы) общей формулы
N (х = 1, 2 или 3);
- ацетилцеллюлоза (триацетат целлюлозы) – сложный эфир целлюлозы и уксусной кислоты n
- нитроцеллюлоза (нитраты целлюлозы) – сложные азотнокислые эфиры целлюлозы: n (х = 1, 2 или 3).
6. Химические свойства
Гидролиз
(C 6 H 10 O 5 ) n + nH 2 O t , H 2 SO 4 → nC 6 H 12 O 6
глюкоза
Гидролиз протекает ступенчато :
(C 6 H 10 O 5 ) n → (C 6 H 10 O 5 ) m → xC 12 H 22 O 11 → n C 6 H 12 O 6 ( Примечание , m
крахмал декстрины мальтоза глюкоза
Реакции этерификации
Целлюлоза – многоатомный спирт, на элементную ячейку полимера приходятся три гидроксильных группы. В связи с этим, для целлюлозы характерны реакции этерификации (образование сложных эфиров). Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом. Целлюлоза не дает реакции "серебряного зеркала".
1. Нитрование:
(C 6 H 7 O 2 (OH ) 3 ) n + 3 nHNO 3 H 2 SO 4(конц.)→ (C 6 H 7 O 2 (ONO 2 ) 3 ) n + 3 nH 2 O
пироксилин

целлюлоза
3n HNO 3
H2SO4 →

тринитрат целлюлозы
3n H 2 О
Полностью этерифицированная клетчатка известна под названием пироксилин, который после соответствующей обработки превращается в бездымный порох. В зависимости от условий нитрования можно получить динитрат целлюлозы, который в технике называется коллоксилином. Он так же используется при изготовлении пороха и твердых ракетных топлив. Кроме того, на основе коллоксилина изготавливают целлулоид.
2. Взаимодействие с уксусной кислотой:
(C 6 H 7 O 2 (OH) 3 ) n + 3nCH 3 COOH H2SO4( конц .)→ (C 6 H 7 O 2 (OCOCH 3 ) 3 ) n + 3 nH 2 O
При взаимодействии целлюлозы с уксусным ангидридом в присутствии уксусной и серной кислот образуется триацетилцеллюлоза.


триацетилцеллюлоза
3n СH 3 СOOН
Триацетилцеллюлоза ( или ацетилцеллюлоза) является ценным продуктом для изготовления негорючей кинопленки и ацетатного шелка . Для этого ацетилцеллюлозу растворяют в смеси дихлорметана и этанола и этот раствор продавливают через фильеры в поток теплого воздуха.
А сама фильера схематично выглядит так:

1 - прядильный раствор,
2 - фильера,
3 - волокна.
Растворитель испаряется и струйки раствора превращаются в тончайшие нити ацетатного шелка.
Говоря о применении целлюлозы, нельзя не сказать о том, что большое количество целлюлозы расходуется для изготовления различной бумаги. Бумага – это тонкий слой волокон клетчатки, проклеенный и спрессованный на специальной бумагоделательной машине.
V . Стадия размышления и рефлексии
Учащиеся составляют таблицу по характеристике крахмала и целлюлозы (таблица). При этом в каждой паре один учащийся заполняет столбец о крахмале, а второй – о целлюлозе, после чего обмениваются результатами.
Таблица
Характеристика
Полисахарид
Крахмал
Целлюлоза
Молекулярная формула
Особенности строения
Структурное звено
Степень полимеризации
Молярная масса
Структура макромолекул
Нахождение в природе
Биологические функции
Физические свойства
Химические свойства
Получение
Применение
VI. Подведение итогов урока. Рефлексия.
Что вам показалось наиболее интересным?
Что больше всего запомнилось?
Что вызвало затруднение?
Что удивило?
Функции углеводов.(Сообщение учащегося)
1. Энергетическая - углеводы служат источником энергии для организма. При окислении 1 г углеводов выделяется 17,6 кДж (4,2 ккал) энергии. Следует отметить, что сахара являются главным источником быстро мобилизуемой энергии, так как в процессе пищеваре ния они легко переводятся в форму, пригодную для удовлетворения энергетических потребностей клеток.
2.Строительная - целлюлоза входит в состав клеточных стенок растений, хитин обнаруживается в клеточной стенке грибов и в наружном скелете членистоногих, гликопротеиды – соединения углеводов с белками входят в состав хрящевой и костной ткани животных.
3. Запасающая – выражается в том, что крахмал накапливается клетками растений, а гликоген – клетками животных. Эти вещества служат для клеток и организмов источником глюкозы, которая легко высвобождается по мере необходимости.
4. Защитная – гепарин – ингибитор свертывания крови; слизи, выделяемые различными железами и богатые углеводами, предохраняют пищевод, кишечник, желудок, бронхи от механических повреждений, препятствуют проникновению в организм бактерий и вирусов; камеди, выделяющиеся в местах повреждения стволов и ветвей, защищают деревья и кустарники от проникновения инфекций через раны.
5. Составная часть жизненно важных веществ – входят вместе с белками в состав ферментов, ДНК, РНК, АТФ.
Домашнее задание. Дополнить таблицу строками «Получение» и «Применение» используя справочную литературу.
Характеристика крахмала и целлюлозы
Характеристика
Полисахарид
Крахмал
Целлюлоза
Молекулярная формула
(С 6 Н 10 O 5 ) n
(С 6 Н 10 O 5 ) n
Особенности строения
α- глюкозы. Степень полимеризации от нескольких сотен до нескольких тысяч. Молярная масса достигает нескольких сотен тысяч г/моль. Структура макромолекул: линейная (амилоза) и разветвленная (амилопектин). В крахмале на долю амилозы приходится 10–20 %, а на долю амилопектина – 80–90 %
Структурное звено – остаток циклической молекулы β -глюкозы. Степень полимеризации от нескольких тысяч до нескольких десятков тысяч. Молярная масса достигает нескольких миллионов г/моль. Структура макромолекул: линейная
Нахождение в природе и биологические функции
В цитоплазме растительных клеток в виде зерен запасного питательного вещества. Содержание (по массе): в рисе – до 80 %, в пшенице и кукурузе – до 70 %, в картофеле – до 20 %
Обязательный элемент клеточной оболочки растений, выполняющий строительную, конструкционную функцию. Содержание (по массе): в волокнах хлопка – до 95 %, в волокнах льна и конопли – до 80 %, в древесине – до 50 %
Физические свойства
Белый аморфный порошок, не растворяется в холодной воде, в горячей воде разбухает и образует коллоидный раствор – крахмальный клейстер (при этом амилоза, как составная часть крахмала, растворяется в горячей воде, а амилопектин только набухает)
Твердое волокнистое вещество, нерастворимое в воде
Химические свойства
(С 6 Н 10 O 5 ) n + n Н 2 О -> n С 6 Н 12 O 6 .
2) Образование сложных эфиров за счет гидроксигрупп (практического значения не имеет).
3) Качественная реакция с йодом – синее окрашивание
1) Образование глюкозы в результате полного гидролиза:
(С 6 Н 10 O 5 ) n + n Н 2 О -> n С 6 Н 12 O 6 .
2) Образование сложных эфиров за счет гидроксигрупп: при взаимодействии с азотной кислотой (в присутствии серной кислоты) – мононитратов, динитратов и тринитратов; при взаимодействии с уксусной кислотой (или уксусным ангидридом) – диацетатов и триацетатов. Все сложные эфиры получили широкое применение.
3) Реакции с йодом не дает
Крахмал (С6Н10О5)n - полисахарид, который состоит из двух фракций: 25% линейной амилозы и 75% разветвленного амилопектина. Он образуется на свету в растениях в
Это вещество представляет собой белый порошок, который не растворяется в холодной воде, образуя взвесь. После отстаивания взвеси на дне ёмкости откладывается белый осадок, а воду легко можно слить. После высыхания крахмал восстанавливает все свои свойства.
В горячей же воде это вещество образует коллоидный раствор - это такая клейкая жидкость, которую ещё называют крахмальным клейстером и часто используют в быту в качестве склеивающего вещества. А ещё на этом его свойстве основано приготовление киселей и некоторых десертов.
Крахмал - это химически инертное вещество. Для того чтобы оно вступило в реакцию, необходимо участие в этом процессе катализаторов.
На его физических и химических свойствах основано применение этого вещества. Так, крахмал и его производные часто применяются в пищевой, текстильной и бумажной промышленностях. И для живых организмов он играет немаловажную роль.
Для использования этого органического вещества в промышленных целях его подвергают химическому воздейстивию. Гидролиз крахмала - это процесс обмена между ионами вещества и водой, который может быть ферментативным или кислотным.
Химический гидролиз крахмала - реакция каталитическая, так как происходит при нагревании в присутствии неорганических кислот. В ходе данной образуется глюкоза, которую можно выразить уравнением:
(С6Н10О5)n + nH2O +(кат. H2SO4+t°) = nC6H12O6.
Но в последнее время большую популярность приобретает ферментативный гидролиз крахмала. Используя специальные технологии, из него получают патоку и глюкозу так же, как и при химическом гидролизе.
Преимущество этого процесса в том, что для него в качестве исходного материала берут крахмалосодержащие растения, например, рожь, картофель, кукурузу, рис и некоторые другие. Эти эти исходники, к тому же, содержат в своём составе амилолитические ферменты, которые и используют в процессе гидролиза.
Например, такими ферментами является изоамилазы и пуллуланазы, глюколиназы. Ферменты - природные катализаторы, которые ускоряют ход химических реакций. Схематически процесс расщепления крахмала под действием ферментов выглядит так: крахмал → растворимый крахмал (амилоза) → олигосахариды (декстрины) → дисахарид (мальтоза = солод) → α-глюкоза. Его можно выразить также уравнением:
(C6H10O5)n + nH2O +(кат.- фермент) = nC6H12O6
Наглядно можно увидеть, что произошел химический гидролиз, проведя эксперимент. Кипятим смесь крахмального клейстера с серной кислотой. Проверяем, произошел ли гидролиз - капаем йод. Если реакция отрицательная, то есть нет синего или фиолетового окрашивания, значит, гидролиз произошел.
Теперь доказываем, что продукт гидролиза - глюкоза. Добавляем к полученному раствору щелочь и (II)(CuSO4). Осадок не выпадает, раствор приобретает ярко-синюю окраску. Нагреваем и видим образование осадка терракотового (кирпичного) цвета - это значит, что в растворе есть глюкоза, которая образовалась в ходе гидролиза.
В организме человека также происходит ферментативный гидролиз крахмала. Этот процесс очень важен, так как при этом образуются углеводы, в частности, глюкоза. Она окисляется в каждой клетке организма, образуя воду и углекислый газ, при этом выделяя энергию, которая необходима для нормального функционирования организма.
Гидролиз крахмала с помощью ферментов начинается в при пережевывании пищи. Слюна человека содержит фермент - амилазу, под действием которой крахмал расщепляется на более простые составляющие - декстрины. Этот процесс человек может даже ощутить. Ведь если долго жевать хлеб, то во рту появляется сладковатый вкус, который и свидетельствует о том, что начался процесс гидролиза крахмала. Избыток глюкозы, которая образуется в ходе гидролиза, откладывается в печени в виде запасного питательного вещества - гликогена.
Тема 4. КИСЛОРОДОСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Урок 46
Тема урока. Крахмал. Строение крахмала. Химические свойства: гидролиз, реакция с йодом
Цели урока: расширить знания учащихся о высокомолекулярные органические соединения, их распространение в природе, строение и свойства на примере природных полимеров полисахаридов - крахмала; развивать знания учащихся о химическом строении высокомолекулярных органических соединений на примере полимерной строения молекул крахмала; познакомить с химическими свойствами крахмала - реакцией поликонденсации и гидролиза; показать их значение для жизнедеятельности живых организмов и человека; изучить качественную реакцию на крахмал; раскрыть связь между свойствами, строением и применением крахмала.
Тип урока: комбинированный урок усвоения знаний, умений и навыков и творческому применению их на практике.
Формы работы: фронтальная работа, учебная лекция, эвристическая беседа, лабораторная работа, демонстрационный эксперимент.
Демонстрация 13. Гидролиз крахмала.
Лабораторный опыт 12. Взаимодействие крахмала с водой.
Лабораторный опыт 13. Взаимодействие крахмала с раствором йода.
Оборудование: мультимедийная схема строения молекул крахмала.
II. Проверка домашнего задания. Актуализация опорных знаний. Мотивация учебной деятельности
Задания для обсуждения в классе записываются или проецируются на доске.
1) В трех пронумерованных пробирках без надписей находятся растворы етаналю, глюкозы и сахарозы. С помощью эксперимента определите содержимое каждой из пробирок.
2) Почему варенье слаще сахара, хотя варится оно с сахаром? Подтвердите свой ответ уравнением реакции.
3) Напишите уравнения реакций, с помощью которых можно осуществить превращения: сахароза этанол.
4) На какие три класса делятся углеводы?
5) Докажите важность реакции фотосинтеза для растений.
6) В чем заключается биологическая роль углеводов?
III. Изучение нового материала
ПОЛИСАХАРИДЫ: КРАХМАЛ, ЦЕЛЛЮЛОЗА
1. Рассказ учителя
Важнейшие из полисахаридов - это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая формула этих полисахаридов - (С6 H 10 O 5)n .
Элементарное звено цепи имеет вид:

Крахмал - это белый порошок, состоящий из мелких зерен, не растворимый в холодной воде. В результате обработки крахмала теплой водой удается выделить две фракции: фракцию, растворимую в теплой воде, состоящей из полисахарида амилозы, и фракцию, лишь набухает в теплой воде с образованием клейстера и состоящую из полисахарида амилопектина.
Крахмал образуется в растениях в процессе фотосинтеза и откладывается в форме «резервного» углевода в корнях, клубнях и семенах. Например, зерна риса, пшеницы, ржи и других злаков содержат 60-80 % крахмала, клубни картофеля - 15-20 %. Подобную роль в животном мире выполняет полисахарид гликоген, что «запасается» преимущественно в печени.
Молекула амилопектина построена подобно, однако имеет в цепи разветвления, что создает пространственную структуру. В точках разветвления остатки моносахаридов связаны (1-6)-гликозидными связями. Между точками разветвления обычно содержатся 20-25 глюкозных остатков.
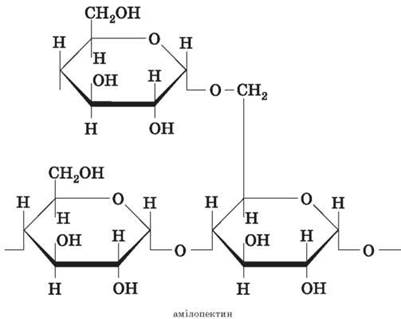
Глюкоза образуется в результате фотосинтеза, накапливается в плодах, листьях и стеблях растений в форме различных полимеров: крахмала и целлюлозы.
♦ Назовите вещества, содержащие большое количество крахмала. (Рис, пшеница, картофель и др.)
Уравнение образования крахмала или целлюлозы можно представить так:
nC 6H 12O 6 (C 6H 10O 5)n + nH 2O
Это реакция называется реакцией поликонденсации, мономер - глюкоза, полимер - целлюлоза или крахмал, побочный продукт - вода.
Крахмалом называется смесь двух полисахаридов, состоящих из остатков циклической α-глюкозы.

В состав крахмала входят:
Амилоза (внутренняя часть крахмального зерна) - 10-20 %;
Амилопектин (оболочка крахмального зерна) - 80-90 %.
Цепь амилозы включает 200-1000 остатков α-глюкозы (средняя молекулярная масса - 160 000) и имеет нерозгалужену строение.

Звенья α-глюкозы «закручивают» макромолекулу в спираль. Это уменьшает вероятность образования міжланцюгових Н-связей, но увеличивает возможность возникновения таких связей с молекулами воды. Благодаря этому амилоза растворяется в воде.
Макромолекула амилозы является спиралью, каждый виток которой состоит из шести звеньев α-глюкозы.

В процессе взаимодействии амилозы с иодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемую соединение включения, которое имеет характерный синий цвет. Эта реакция используется в аналитических целях для обнаружения как крахмала, так и йода (йодокрохмальна проба).
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1-6 млн.

В отличие от амилозы, амилопектин имеет разветвленную структуру. В точках разветвления звенья соединяются за счет отщепления воды от групп α - OH и CH 2 - OH .
Подобно амилопектина построен и гликоген (животный крахмал), макромолекулы которого отличаются значительной разветвленностью.
Реакция взаимодействия крахмала и целлюлозы с водой - гидролиз, происходит при нагревании в кислой среде или под действием ферментов.
Демонстрация 13. Гидролиз крахмала (в присутствии серной кислоты)
2. Химические свойства крахмала
Крахмал легко гидролизуется: в процессе нагревания в присутствии серной кислоты образуется глюкоза.
В зависимости от условий проведения реакции гидролиз может осуществляться поэтапно с образованием промежуточных продуктов.
Качественной реакцией на крахмал является его взаимодействие с йодом: наблюдается интенсивное синее окрашивание. Такое окрашивание появляется, если на срез картофеля или ломтик белого хлеба капнуть раствор йода.
Крахмал не вступает в реакцию «серебряного зеркала».
Крахмал является ценным пищевым продуктом. Для облегчения усвоения крахмала продукты, содержащие его, термически обрабатывают, т. е. картофель и крупы варят, хлеб пекут. Процессы декстринизация (образование декстринов), при этом происходят, способствуют лучшему усвоению организмом крахмала и следующем его гидролиза до глюкозы.
В пищевой промышленности крахмал используется в производстве колбасных, кондитерских и кулинарных изделий. его также применяют для получения глюкозы, в производстве бумаги, текстиля, клеев, лекарственных средств и тому подобное.
IV. Первичное применение полученных знаний
Управляемая практика
Лабораторный опыт 12. Взаимодействие крахмала с водой
Щепотку крахмала растворяем в холодной воде. Что наблюдаем?
Медленно, придерживаясь правил техники безопасности и правил нагрев, нагреваем содержимое пробирки.
Лабораторный опыт 13
В полученный клейстер добавьте две-три капли разбавленного раствора йода. Что наблюдаем?
Появление фиолетово-синей окраски указывает на наличие крахмала в растворе.
Вывод - действие йода является качественной реакцией на наличие крахмала в веществе.
V. Тренировочные упражнения
Групповые задания
Каждая группа выполняет задание и представляет на обсуждение в классе.
Задача 1. Вычислите количество крахмала, который образуется в результате фотосинтеза, если растения выделяют при этом 10 т кислорода.
Задание 2. В двух пробирках содержатся крахмал и глюкоза. Как с помощью опыта распознать эти вещества?
Задание 3. Нитроцеллюлозы - продукты взаимодействия целлюлозы и азотной кислоты, чрезвычайно горючи. Тринітроцелюлоза (пироксилин) - взрывчатое вещество, которое применяют в производстве бездымного пороха. Во время взрыва происходит процесс разложения. Запишите уравнение реакции:
![]()
Задание 4. Подумайте, почему из целлюлозы можно получить волокна, а из крахмала - нет.
VI. Подведение итогов урока
♦ Какие новые понятия вы изучили сегодня на уроке?
♦ Какое практическое значение для вас имеют полученные сегодня знания?
Подводим итоги урока, оценивает работу учащихся на уроке.
VII. Домашнее задание
Проработать материал параграфа, ответить на вопросы к нему, выполнить упражнения.
Творческое задание: исследуйте различные продукты питания на наличие крахмала и составьте отчет.
